Protezione dalla corrosione
1) COS’E’ LA CORROSIONE
La corrosione è un fenomeno chimico di graduale e irreversibile deterioramento di un metallo per effetto di agenti esterni.
Il ferro, per natura, tende al suo equilibrio legandosi con l’ossigeno e infatti si trova sotto forma di ossido in minerali come l'ematite (Fe2O3) e la magnetite (Fe3O4).
L’estrazione del ferro dal minerale consiste in un processo metallurgico che trasforma il minerale (es l’ematite Fe2O3) in ferro (es. 2Fe+3/2O2)
La corrosione può quindi essere considerata come la reazione inversa del processo di estrazione, che riporta il metallo al suo stato naturale (Fe2O3)
Estrazione del metallo —> Fe2O3 —> 2Fe+3/2O2 —> Stato ad alta energia (instabile)
Corrosione —> 2Fe+3/2O2 —> Fe2O3 —> Stato a bassa energia (stabile)
La corrosione agisce tramite lo scambio di elettroni fra il ferro che li cede (ossidazione) e l’ossigeno che li acquista (riduzione) in presenza di un elettrolita (es. l’acqua):
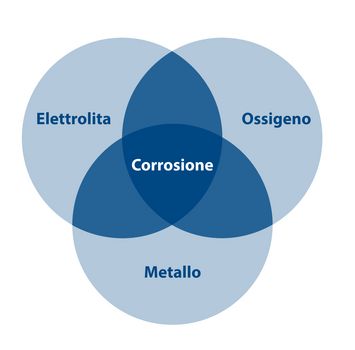
Ferro, aria e una goccia d’acqua sono un tipico esempio di meccanismo corrosivo:
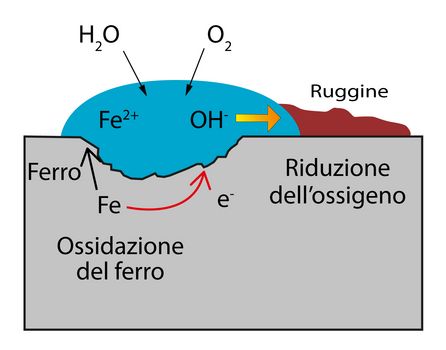
Dove:
Il ferro perde elettroni —> Fe —> Fe2+ + 2 e-
L’ossigeno acquista elettroni —> O2 + 2 H2O + 4 e- —> 4 OH-
Gli ioni Fe2+ e OH- reagiscono nella goccia d’acqua in presenza di ossigeno e si trasformano in ruggine (chimicamente definibile come ossido idrato di ferro)
La ruggine è un materiale poroso e friabile che tende a staccarsi dalla superficie lasciando le zone sottostanti esposte a ulteriore ossidazione e questo spiega il concetto di gradualità e irreversibilità con cui abbiamo iniziato questo articolo.
La corrosione avviene tanto più rapidamente quanto maggiore è la conducibilità elettrica della soluzione acquosa, ed è per questo che nei litorali marini, ricchi di salsedine, la corrosione del ferro è più veloce.
2) TIPI DI CORROSIONE
UNIFORME
PITTING
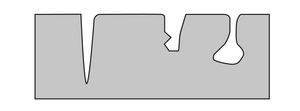
INTERSTIZIALE
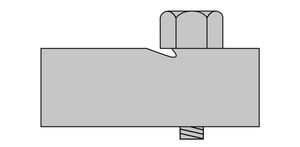
INTERGRANULARE
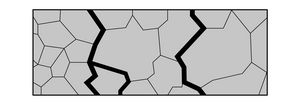
GALVANICA
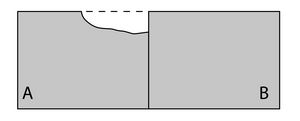
INFRAGILIMENTO AMBIENTALE
Corrosione distribuita in modo relativamente uniforme sulla superficie che provoca una dissoluzione omogenea del metallo. La velocità di corrosione e la durata di un componente possono essere calcolate misurando l'assottigliamento complessivo determinato.
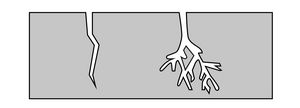
Forma di corrosione localizzata che genera piccoli fori nel metallo. Colpisce tipicamente gli acciai inossidabili che devono la loro resistenza alla corrosione a un sottile strato di ossido sulla superficie. Il processo è solitamente avviato dagli ioni di cloruro e comincia con una frattura locale dello strato passivo per poi procedere in profondità
Si verifica nelle crepe o negli interstizi formatisi tra due superfici e provoca un attacco localizzato (alveoli). Può verificarsi sotto rondelle o guarnizioni se non si previene l'infiltrazione dell'acqua sottostante.
Consiste nella la dissoluzione preferenziale dei bordi intergranulari. Un esempio è la sensibilizzazione dell'acciaio Inox: quando determinate qualità di questo materiale vengono tenute a temperature comprese tra 500°C e 800°C per un periodo considerevole, ad esempio durante un processo di saldatura, si formano carburi ricchi di cromo (C6Cr23) che provocano un impoverimento del cromo a bordo grano (aree di discontinuità chimicamente più attive) che si troverà a un grado inferiore di resistenza alla corrosione rispetto al materiale residuo, innescando un attacco corrosivo localizzato che può determinare anche rotture per tensocorrosione.
Forma di corrosione che si attiva quando due materiali con potenziale elettrico differente sono a contatto tra loro in presenza di un elettrolita. Generalmente, il metallo meno nobile viene dissolto. Sono la differenza di potenziale tra catodo (es. inox) e anodo (es. alluminio) e la presenza di un elettrolita (es acqua salata) che creano la cella galvanica. Di fatto si forma la così detta pila di volta, per cui il metallo più nobile attrae elettroni da quello meno nobile accelerandone così l’ossidazione.
Vediamo per esempio in fig.1, L’acciaio inox e il nickel sono “galvanicamente compatibili”, mentre il nickel e il cromo, che hanno una differenza di potenziale di 770mV, sono
“galvanicamente incompatibili”. Si formerà un passaggio di cariche negative dal cromo-anodo, al nickel-catodo, con la conseguente corrosione del cromo.
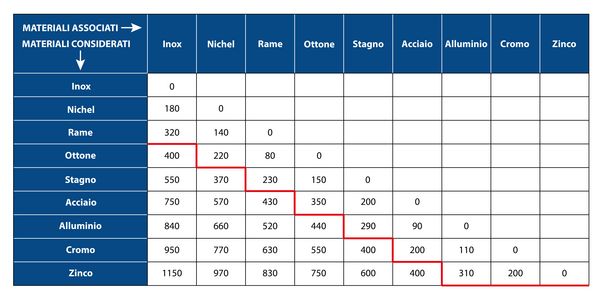
Le differenze di potenziale sono espresse in millivolt (mV)
Sotto la linea rossa, il metallo considerato viene attaccato
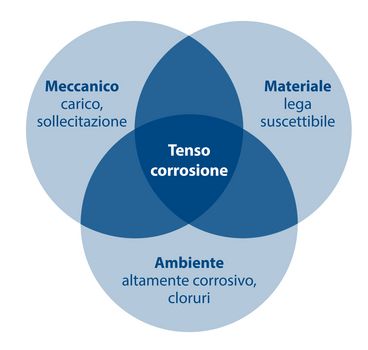
Tensocorrosione (SCC - stress corrosion cracking)
Danneggiamento che richiede l'azione simultanea di una tensione meccanica e di un agente corrosivo. Può provocare un improvviso cedimento di metalli normalmente duttili soggetti a livelli di sollecitazione molto inferiori alla loro tensione di snervamento.
3) SOLUZIONI ALLA CORROSIONE: ACCIAI INOSSIDABILI
L'acciaio legato con almeno il 10% di cromo è detto acciaio inox. Il cromo provoca la formazione di uno strato superficiale di ossido molto sottile e stabile detto strato di passivazione che protegge l’acciaio dalla corrosione.
Ci sono tuttavia una serie di fattori che è bene tenere sotto controllo per evitare brutte sorprese.
Se si utilizzano acciai inossidabili che possono essere soggetti ad alte temperature è bene considerare un elemento di collegamento in AISI 304L o AISI 316L, detti anche low carbon, dove il tenore di carbonio passa da 0,07 a 0,03% annullandone l’effetto sensibilizzante (non c’è abbastanza carbonio per formare i carburi di cromo) e prevenendo così la CORROSIONE INTERGRANULARE vista nel capitolo 2.
In altre circostanze, esempio la presenza di ioni di cloruro, lo strato di passivazione può spezzarsi innescando il PITTING visto al capitolo 2. La resistenza dell'acciaio inox contro questa insidiosa forma di corrosione può essere stimata attraverso il:
PREN (Pitting Resistance Equivalent Number)
Il PREN si basa sulla composizione chimica dell'acciaio, tiene tipicamente conto della quantità di cromo, molibdeno e azoto e viene calcolato comunemente secondo le seguenti equazioni:
PREN = %Cr + 3.3 x %Mo (per acciaio inox Mo < 3%)
PREN = %Cr + 3.3 x %Mo + 30 x %N (per acciaio inox Mo ≥ 3%)
Di seguito alcuni valori tipici del PREN per gli acciai austenitici più diffusi:
AISI 304 —> PREN range 17,5-20,8
AISI 316 —> PREN range 24,75-28,51
Duplex 2205 —> PREN range 30,85-38,6
In linea generale, acciai con un PREN > 32 possono essere ritenuti resistenti agli ambienti marini.
Valutazioni sulla resistenza alla corrosione per i prodotti in acciaio inox sono contenute nella EN 1993-1-4 dove un sistema di punteggio prende in considerazione una serie di rischi, e viene calcolato un fattore di resistenza alla corrosione:
CRF (Corrosion Resistance Factor)
Ciascun fattore di rischio (cloruri, diossido di zolfo, effetto lavaggio) è collegato a un certo numero di punti e il CRF viene calcolato come segue:
CRF = F1 + F2 + F3
Dove:
F1 = rischio di esposizione ai cloridi dall'acqua salmastra o dai sali antighiaccio
F2 = rischio di esposizione al diossido di zolfo
F3 = regime di pulizia o esposizione al lavaggio da parte della pioggia
Sommando tutti i fattori (per il dettaglio si rimanda alla prospetto A1 della EN 1993-1-4) si ottiene il CRF che viene quindi correlato a cinque classi di resistenza alla corrosione, e agli acciai inossidabili più diffusi:
I —>CRF = 1
II —> 0 ≥ CRF > -7 —> es. AISI 304
III —> -7 ≥ CRF > -15 —> es. AISI 316-316L-316Ti-duplex 2304
IV —> -15 ≥ CRF ≥ - —> es. Duplex 2205
V —> CRF < -20 —> es. HCR
4) SOLUZIONI ALLA CORROSIONE: RIVESTIMENTI PROTETTIVI A BASE DI ZINCO E SUE LEGHE
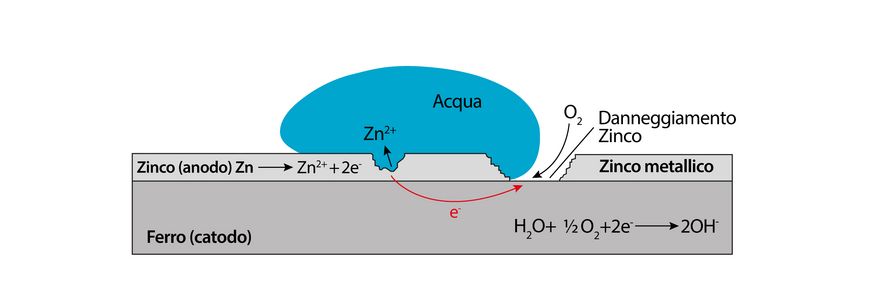
La protezione dello zinco nei confronti dei metalli ferrosi ha una duplice natura:
1. Lo zinco in superficie reagisce con l’aria umida formando l’ossido di zinco, che è stabile.
2. Lo zinco offre una protezione elettrochimica. Ogni metallo ha un suo potenziale elettrochimico: quello del ferro è -0,44V e quello dello zinco è -0,76V. Quando due metalli si trovano immersi in un elettrolita si ha passaggio di elettricità (elettroni) come in una "pila" ed il metallo più' elettronegativo (lo zinco) si “sacrifica” perdendo elettroni e corrodendosi al posto del ferro.
Esistono varie tipologie di rivestimento a base di zinco e sue leghe che offrono vari livelli di protezione. Nella tabella sotto vengono riportate le più importanti:
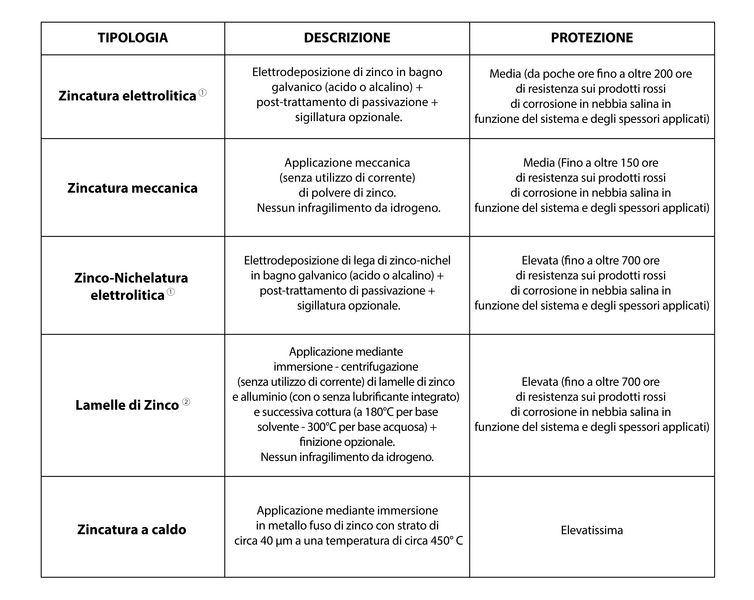
① Possibili stratificazioni
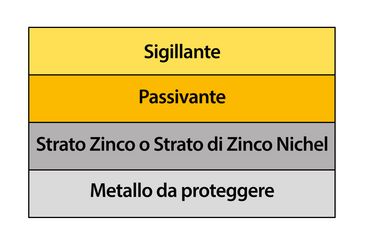
② Possibili stratificazioni

Nella tabella sotto vengono riportate le caratteristiche tipiche dei rivestimenti a base zinco e sue leghe:
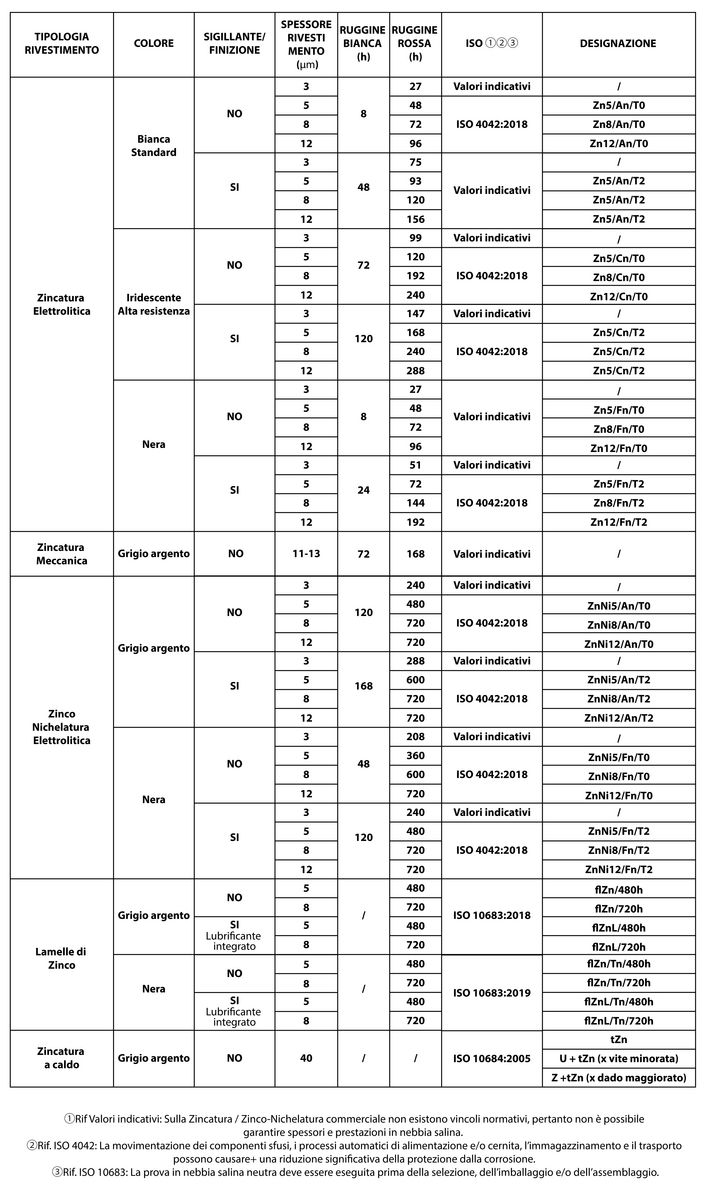
5) SOLUZIONI ALLA CORROSIONE: ALTRI RIVESTIMENTI PROTETTIVI/DECORATIVI